بیماری ویروسی آبله آلو ( شارکا )
بیماری ویروسی آبله آلو ( شارکا )
Plum Pox Virus
مقدمه
هر ساله عوامل ویروسی و شبه ویروسی خسارات سنگینی به درختان میوه سراسـر دنیـا وارد مـی آورنـد. بر اساس گزارشات منتشر شده، تا کنون بیش از 150 بیماری ویروسی، ویروئیدی، فایتوپلاسمایی و همچنین عوامـل ناشناخته قابل انتقال با پیوند، می توانند از نظر اقتصادی آثار بسیار مخربی در انواع محصولات گیاهی ایجـاد نماینـد. از این رو شناسایی عامل بیماری و تعیین خصوصیات آن را می توان به عنوان اولین و ضروری ترین گام در کنتـرل موثر این نوع بیمارگر ها دانست. هدف از این مقاله، ارائه مطالب مورد نیاز جهت ردیابی و تشخیص ویـروس آبلـه آلو ( ( Plum Pox Virus (PPV ) به عنوان یکی از مخرب ترین بیمارگرهای ویروسی درختان میوه هسته دار میباشد.
بیماری ویروسی آبله آلو شارکا ( نام اسلوواکیایی بیماری ) ناشی از ویروس آبله آلو، یکی از بیماریهای مهـم درختـان میـوه هسته دار از قبیل آلو، هلو، شلیل، بادام و زردآلو می باشد. بررسی های انجام شده در مـورد اثـرات اقتـصادی ایـن بیماری، نشان می دهد که میزان خسارت تا حد زیادی به حساسیت و یا مقاومت رقـم کاشـته شـده بـستگی دارد؛ بطوری که در واریته های حساسَ آلوده به PPV ، این مقدار 83 تا 100 درصد برآورد شده است.
بیماری شارکا با اثر روی کاهش کمیت و کیفیت محصول و عدم بازار پسندی میوه ها، ضعف و از بـین بردن درختان جوان، و در نهایت کاهش عمر مفید درخت و به طور کل مشکلاتی که بر سر راه تجارت جهانی ایـن نوع محصولات گیاهی ایجاد می نماید، صنعت تولید میوه درختان هسته دار را با خطر جدی مواجه ساخته است.
پراکندگی
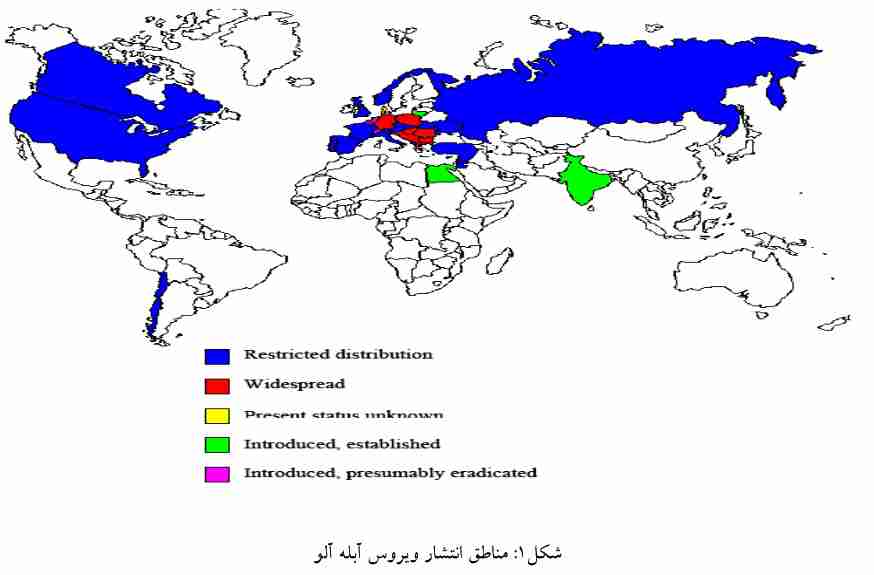
ویروس آبله آلو اولین بار در سال 1915 در جنوب غـرب بلغارسـتان روی آلـو مـشاهده شـد و در حـال حاضر یکی از خطرناک ترین بیماری های جنس Prunus ( هلو، زردآلو، شلیل، هلـو، گـیلاس، آلبـالو، بـادام و انـواع گونه های وحشی زینتی) به شمار می آید. این بیماری به کندی از قسمت شمالی به سمت شرق اروپا گسترش یافـت به طوریکه 20 سال بعد یعنی در سال 1935 از یوگوسلاوی و سپس در سال 1941 از لهستان گزارش شد.
گزارش آلودگی PPV در سال 1956 از آلمان، 1970 از فرانسه و 1984 از اسپانیا منتشر گردید بـه طـوری که در اوایل دهه1990 ، تخمین زده شد که100 میلیون اصله درخت در اروپا بـه ایـن ویـروس آلـوده مـی باشـد. در 1992، برای اولین بار علائم بیماری در یک باغ تحقیقاتی در شیلی دیده شد که هم اکنون این بیماری در آن کـشور بطور گسترده مستقر شده است. در سال 2004، Dal Zotto و همکاران، PPV را از یک باغ آلو و زردآلو در آرژانتـین گزارش کردند. آمریکای شمالی با اجرای موازین سخت قرنطینه ای سعی در جلوگیری از ورود ویروس را داشت، تا اینکه در سال 1999 در ایالت پنسیلوانیا و در سال 2000 در کانادا حضور عامل بیماری به اثبات رسید. این بیماری تا کنون از کشورهای استرالیا و نیوزیلند گزارش نشده است.
Roy & Smith در سال 1994 اروپا را از نظر شدت و وسعت آلودگی به PPV به سه ناحیه تقسیم بندی کردند:
- کشور های مرکزی و شرقی اروپـا کـه وسـعت و شـدت آلـودگی در آن هـا بـسیار بـالا اسـت: بوسـنی هرزگووین، بلغارستان، جمهوری چک، مجارسـتان، مولـداوی، لهـستان، رومـانی، صربـستان، اسـلوواکی، اسلوونی و اکراین.
- کشور های حوزه مدیترانه که طی دهه گذشته آلودگی در آن ها دیده شده و خطر گسترش آلودگی در ایـن کشورها بسیار زیاد است: آلبانی، قبرس، مصر، یونان، ایتالیا، پرتغال، اسپانیا، سوریه، ترکیه.
- کشور های شمالی و غربی اروپا که گسترش آلودگی در آنها بسیار متغیر است بطوریکه در اطریش، آلمـان وانگلستان نسبتا پراکنده، در بلژیـک، فرانـسه و لوکزامبـورگ گـسترش محـدود و در دانمـارک، هلنـد و سوئیس ریشه کن شده است. اخیرا این ویروس در جنوب روسیه گسترش یافتـه اسـت. PPV در اسـتونی نیز گزارش شده ولی هنوز در آن کشور استقرار پیدا نکرده است.
این ویروس در تعدادی از کشورهای آسیایی ازجمله هند، سوریه و ترکیه آلودگی داشته است. همچنـین گزارشـاتی حاکی از حضور آن در آذربایجان و گرجستان وجود دارد؛ البته این گزارشات هنوز مورد تائید قرار نگرفته اند.
دامنه میزبانی
تحت شرایط طبیعی، PPV به راحتی قادر به ایجاد آلودگی در گیاهان جنس Prunus که یا از واریته های تجاری هستند و یا روی این نوع پایه ها پیوند زده شده اند، می باشند. دامنه میزبانی این ویروس شامل درختان:
زردآلو((P. armeniaca ، آلوی اروپایی (P. domestica) و آلوی ژاپنی (P. salicina) ، انواع هلو((P. persica ، P. cerasifera، P. cerasifera×munsoniana cv. Marianna ،آلبالو (Prunus cerasus) ، گیلاس ] (Prunus avium)در بلغارستان و مولداوی [ و بادام (P. dulcis)، به عنوان میزبانهای اصلی این ویروس میباشند. علائم بیماری در بادام به صورت خفیف ظاهر می شود.
در بعضی از اعضای گروه microcerasus از زیر جنس Cerasus ، می توان به در شرایط آزمایشگاهی آلودگی ایجاد کرد، ولی این عمل در اعضای گروه های eucerasus (گیلاسها)، Pseudocerasus (زینتیهای این گروه) ، Padus (گیلاس های مخصوص پرندگان)، یا Laurocerasus (گیلاس لورل) مقدور نمی باشد. در صورت تلقیح مکانیکی PPV به انواع گونه های گیلاس، انتقال صورت گرفته ولی آلودگی به صورت موضعی در محل تلقیح باقی مانده و در گیاه پخش نمی شود. با این وجود، گزارشهایی وجود دارد که نشان می دهد این ویروس در مولداوی و بلغارستان به طور طبیعی در گیلاس و آلبالو ایجاد بیماری نموده است.
میزبان های وحشی و زینتی جنس Prunus که بطور طبیعی توسط این ویروس آلوده میگردند عبارتنـد از:
- besseyi, P. cerasifera, P. insititia, P. tomentosa. P. spinosa و .P. triloba
گزارش شـده اسـت کـه بـسیاری دیگر از گونه های گیاهی یک ساله علفی میتوانند به طور بالقوه اینوکلوم ویروس را در خود نگـه دارنـد. امـا انتقـال طبیعی ویروس از این گیاهان علفی به گونه های Prunus spp. هنوز به اثبات نرسیده است.
از گیاهان محک آزمایشگاهی می توان Nicotiana benthamiana ، Nicotiana glutinosa، Pisum sativum، را نام برد.
شدت بیماریزایی و عکس العمل ( نوع علائم ) هر یک از ارقام میزبان، علاوه بر رقم کاشته شده Prunus، به استرین ویروس، سن گیاه، فصل، محل جغرافیایی منطقه و حتی وضعیت تغذیـه گیـاه نیـز بـستگی دارد. بـه عنـوان نمونه، آلودگی درختان آلوی اروپایی (European plums)، سبب ریزش نابهنگام میوه های نارس شده و این درحالی است که بیماری روی درختان هلو و آلوی ژاپنی، لکه های حلقوی میوه و در زرد آلو بدشکلی شدید میوه را ایجـاد می کند. همچنین بروز علائم این ویروس در گیلاس بصورت ریزش میوه های نارس و ایجـاد لکـه هـای حلقـوی کلروتیک و نکروتیک یا فرورفتگی دیده می شود.
تـاکنون شـش اسـترینَ ، PPV-M) Marcus، (PPV-D) Dideron، (PPV-EA) El Amar ، (PPV-C) Cherry ،(PPV-W) Winona و PPV-Rec) Recombination) از این ویروس گزارش شده اسـت کـه هـر شـش اسـترین بـا خصوصیات زیست شناسی (بیماریزایی، قابلیت انتقال با شته و نوع علائم ایجاد کننده روی درختان میوه هسته دار)، سرولوژیکی و مولکولی متفاوت و همچنین رفتارهای همه گیری (اپیدمیولوژیکی) مختلف بـه سـهولت از یکـدیگر فابل تفکیک می باشند. بطوریکه ایزوله های M بسیار سریع تر از ایزوله های استرین D توسط شته انتقال می یابنـد و علائم حاصل از آلودگی این استرین در هلو بسیار شدید است. در حالی که استرین D بطور طبیعی تنهـا قـادر بـه آلودگی زردآلو و هلو است و به ندرت در هلو یافت می شود. در اروپا گزارش های منتشر شده از بیمـاری شـارکا، غالبا از استرین های PPV-M و PPV-D بوده در صورتیکه استرین PPV-EA از مصر و استرین PPV-C با خصوصیات مختلف سرولوژیکی و مولکولی از دیگر استرین های PPV، بعد از کـشف ایزولـه هـایی کـه قـادر بـه آلودگی گیلاس بودند معرفی شد و مدت زیادی تنها در کشورهای اروپای شرقی(مولداوی و رومانی) وجود داشت. ولی در طول دهه 1990 در جنوب فرانسه و شمال ایتالیا نیز خسارت اقتصادی قابل توجهی به درختان هلوی کاشته شده وارد آورد. استرین((PPV-Rec در سال 2002 از آلبانی، بلغارستان، چک، آلمان ، لهستان، اسلواکی و رومـانی و استرین PPV-M اخیرا در تعدادی از کشورهای خاور میانه ماننـد اردن و سـوریه و اسـترین PPV-W نیـز در سـال 2009 از کانادا گزارش شده است.
ارقام مقاوم که آلودگی در آنها بدون علائم است خطر بیشتری نسبت به ارفام حساس دارند. واضح اسـت که حضور این نوع گیاهان به عنوان منبع بالقوه آلودگی می تواند تاثیر بسزایی در گسترش بیماری در باغات داشـته باشد. بنابراین به محض اثبات آلودگی درخت، می بایست عمل ریشه کنی توسط مقامات مسئول صورت پذیرد.
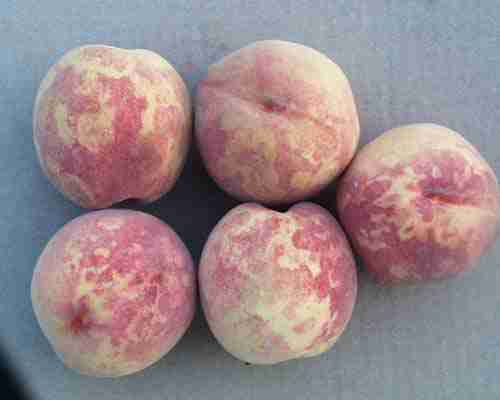
نشانه های بیماری روی برگ، گلبرگ، میوه و هسته دیده می شود. علائـم واضـح بیمـاری در فـصل بهـار روی برگ ها شامل: تغییر رنگ خفیف بـرگ هـا، لکـه هـای کلروتیـک و در برخـی مـوارد حالـت بافـت مردگـی ( نکروتیک)، لکه حلقوی، رگبرگ روشنی یا رگبرگ زردی و حتی تغییر شکل برگ ها می باشد. نشانه هـا معمـولا روی تعداد کمی از برگهای شاخه پدیدار میشوند.
تغییر رنگ گلبرگ تا کنون در گل های برخی از ارقام هلو دیده شده است. روی میوه های آلـوده نیـز حلقـه هـای کلروتیک یا حلقه هایی به رنگ زرد روشن و در برخی موارد نقوش مشبک دیده می شـود. میـوه هـا ممکـن اسـت بدشکل و نامنظم شده و نواحی کوچک قهوه ای و بافت مرده (نکروتیک) روی آنها دیده شود. قهوه ای شد ن داخـل میوه سبب کاهش کیفیت محصول می گردد. در برخی موارد، ریزش شدید میـوه هـای نـارس از درخـت، یکـی از بهترین نشانه ها برای تشخیص آلودگی می باشد. بطورکلی، واریته های زوررس از نظر ظهور علائم بیماری بـسیار حساس تر از واریته های دیررس می باشند. لکه ها و حلقه های کمرنگ روی هسته نیز در هسته میوه آلوده زردآلو دیده شده است. گوشت میوه در اطراف هسته خشک و روی این قسمت معمولا حلقه های رنگ پریده، خطـوط، یـا لکه هایی نمایان میشود.
انتقال
بیماری ویروسی آبله آلو ( شارکا ) هم از طریق پیوند و هم توسط حداقل 20 گونه شته ناقل بصورت ناپایـا انتقـال مـییابـد.
Aphis spiraecola و Myzus persicae بـا کـارائی بـالا و شـته هـای دیگـر از جملــه Aphis craccivora, A. fabae, Brachycaudus cardui, B. helychrysi, B. persicae, Hyalopterus pruni, Myzus varians, Phorodon humuli بـا سطح کارایی پائینتر، قادر به انتقال ویروس هستند.
Aphis gossypii ، Rhopalosiphum padi و A. hederae نیز اخیـرا بـه عنـوان نـاقلین ویـروس آبلـه آلـو گزارش شده اند.
این شته ها قادرند در زمان کمتر از 30 ثانیه ویروس را کسب کرده و تا یک ساعت آن را نگهـداری و انتقال دهند؛ این زمان با طولانی شدن مدت گرسنگی شته ها تـا 3 سـاعت افـزایش یافتـه و شـته توانـایی انتقـال ویروس را بخوبی حفظ می کند. Maiss و همکاران در سـال 1989 و Lopez-Moya و همکـاران در سـال 1995 نیـز تعدادی ایزوله غیر قابل انتقال توسط شته را شناسایی کردند. بطور کلی قابلیت انتقال ویـروس توسـط شـته تنهـا در فواصل کوتاه دارای اهمیت است. بنابراین آنچه که در مباحث قرنطینه ای می بایست مورد توجه واقع شود، قابلیـت پایداری و انتقال عامل بیماری در اندام های تکثیری آلوده و انتقال آن به مناطق عاری از بیماری می باشد.
طبقه بندی
Name:Plum pox potyvirus
Synonyms:Sharka virus
Taxonomic position: Viruses: Potyviridae: Potyvirus
بیماری ویروسی آبله آلو ( شارکا ) به مدت طولانی تنها Potyvirus آلوده کننده درختان میوه بـه شـمار مـی رفـت، امـا در سـال 1994، Hadidi وLevy از نهال های وارداتی هلو و Prunus mume از آسیای شرقی به آمریکای شمالی، ویـروس دیگـری را شناسایی کرده وآن را Asian prunus latent potyvirus نامگذاری کردند. دو ویروس مذکور تنها از روشهای مبتنـی بر آغازگر های اختصاصی ژنوم قابل تمایز می باشند؛ زیرا وجود واکـنش تقـاطعی ایـن دو (cross-reacts)، شناسـایی آنها را با استفاده از روشهای دیگر مانند روشهای سرولوژیک دشوار میسازد.
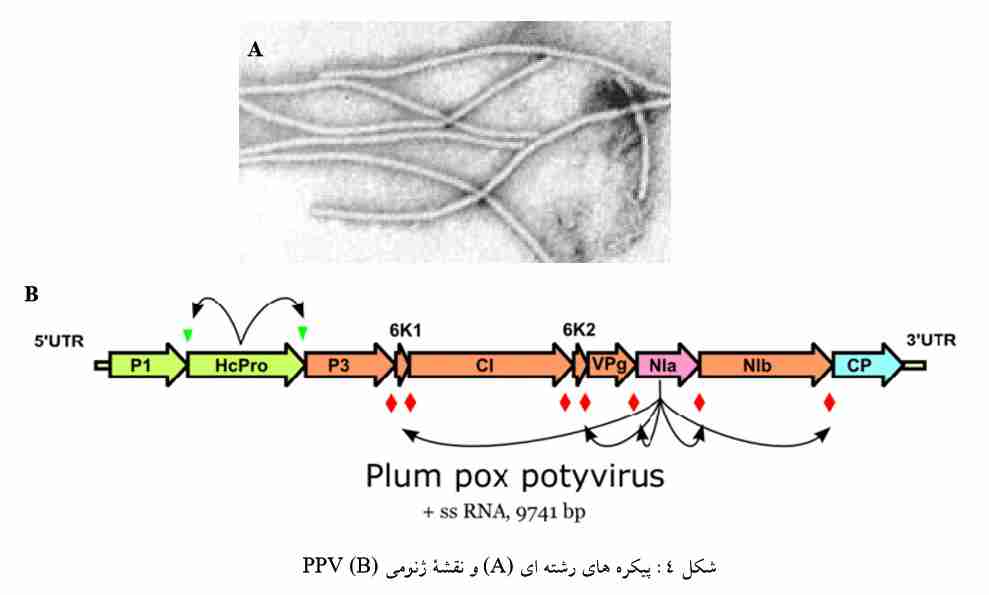
پیکــره هــای رشــته ای PPV ، محتــوی اســید نوکلئیــک تــک رشــته ای از نــوع +ssRNA بــا انــدازه 9.7 kb مــی باشــد (شکل 4 A,B ) . قطر ویرون های ویروس764 × 20 ناتومتر محاسبه شده است. ژنوم ویروس، کد کننده یک پلی پروتئین 350 kDa می باشد که بعدا این پلی پروتئین در محلهای خاصی توسط آنزیم های تجزیه کننده پـروتئین (پروتئازهـا) ویروسـی و همچنـین آنـزیم هـای گیاهی به چند کوچکتر شکسته میشود و محصول نهایی ژنها تولید میگردد. این نوع استراتژی ژنوم برای ترجمه پـروتئینهـا تنهـا در گـروه Potyvirus دیده شـده است. ایـن پروتئینهـا عبارتند از: پـروتئین پوششی ویـروس و ترکیبات کمکـی helper components (HC pro) که در بیماری زایی ویروس نقش دارند، اندامکهای ویژه سیتوپلاسـمی و فرفـره ای شـکل پروتئینـی کـه احتمالا در همانند سازی RNA نقش دارند ( Cylindrical inclusion protein ( CI ، اندامک ویژه بدون شکل معین کـه احتمـالادر انتقال ویروس توسط حشره نقش دارند، دو نوع اندامک ویژه هسته ای پروتئینی با وزن مولکولی 58 و 49 کیلـو دالتـون کـه در بعـضی از آلودگی های پوتیویروسها مشاهده شده است nuclear inclusion proteins (NIa and NIb)، پروتئین پوششی که ژن مربوط به آن در انتهایَ3 ژنوم قرار دارد (coat protein (CP ، پـروتئین نـسبتا کـوچکی کـه بـه انتهـایَRNA 5 ژنـومی متـصل اسـت و نقـش محافظتی برای آن دارد. به این پروتئین اصطلاحا (virus protein genome linked (VPg گفته میشود. و چند پروتئین کوچـک دیگر نیز تولید می شود.
روشهای شناسایی
در گذشته استفاده از روشهای بیولوژیکی در تشخیص بیماری های ویروسی گیاهان یکی از متداول ترین روش های شناسایی به حساب می آمد. ولی امروزه کاربرد این روش ها بـه دلیـل زمـان بـر بـودن آنهـا و افـزایش احتمال خطا، به سرعت توسط روشهای سرولوژیکی و مولکولی پیشرفته (تکنیـک هـای مبتنـی بـر PCR و دو رگ گیری نشانگرها) جایگزین شده است. بنابراین استفاده از تکنیک های اخیر در مباحث مربوط بـه قرنطینـه نبـاتی و افزایش داد و ستد جهانیَ کالاهای کشاورزی و در نتیجه نیاز روز افزون به تشخیص سریع بیمارگرهـای گیـاهی، از اهمیت بسیار بالایی برخوردار می باشد.
با این وجود، کاربرد اینوکولوم ویروس و تلقیح مکانیکی آن به گیاه محک هنوز هـم بـه عنـوان یکـی از ابزارهای مفید و ضروری در مطالعات مربوط به بیمارگرهـای جدیـد و همچنـین تولیـد انـدام هـای تکثیـری (ژرم پلاسم) عاری از ویروس کاربرد فراوانی دارد.
نمونه برداری
در ردیابی و تشخیص عوامل ویروسی و شبه ویروسیَ درختان میوه، اجرای صحیح و منظمَ نمونه بـرداری (به عنوان اولین مرحله شناسایی) بسیار حائز اهمیت می باشد. کارشناس و یا بـازرس مـسئول، عـلاوه بـر تـسلط و آگاهی کامل به نوع علائم حاصل از بیماری آبله آلو، می بایست نکاتی در مورد نمونه برداری به خاطر داشـته باشـد که رعایت این موارد در اجرای صحیح عملیات ردیابی بسیار مؤثر خواهد بود:
- انتخاب اندام گیاهی مناسب
- توزیع نامنظم بیمارگر در گیاه
- اثر عوامل محیطی
1 – انتخاب اندام گیاهی مناسب از آن جهت دارای اهمیت است که غلظت عامل بیماریزا در تمامی بافت های گیاهی یکسان نبوده و استفاده از بافت هایی با حداکثر غلظت ویروس، در تشخیص موفق آن بسیار مهم می باشد. برای تعیین وجود PPV در درخت، گرچه نمونه برداری از تمامی قسمتهای گیاه از جمله گلها، برگهای جوان، برگهای پیر، میوه، چوب خفته و ریشه امکانپذیر است، لیکن نمونه برداری از بافت برگی و در صورت امکان گلبرگها، مطمئن ترین نتیجه را در پی خواهد داشت.
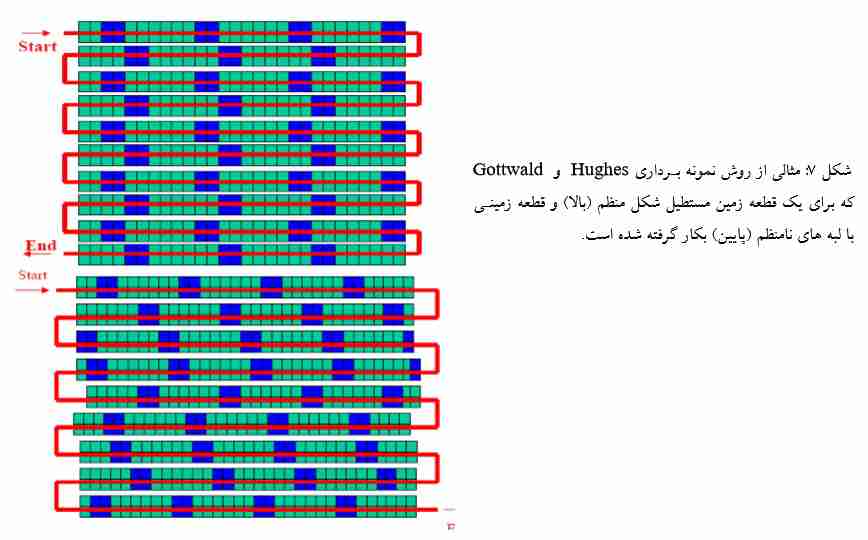
2 – توزیع نامنظم برخی بیمارگرها در گیاه ( برای مثال ویروس آبله آلو و فایتوپلاسما ها) می تواند انجام عملیات ردیابی را با مشکل مواجه سازد؛ به طوری که در بسیاری از موارد دیده شده است که تنها چند برگ در کل درخت علائم آلودگی را نشان می دهند لذا به منظور سهولت در انجام نمونه برداری، استفاده از سیستم نمونه برداری Hughes و Gottwald در بخش روش نمونه برداری در باغ شرح داده شده است.
3 – عوامل محیطی خصوصاِ درجه حرارت میتواند تا حد زیادی بر نتیجه آزمایش تأثیر گذار باشد (برای مثال غلظت ویروس ها به طور معمول در بهار بسیار بالا تر از فصول دیگر بوده در صورتی که غلظت ویروئیدها و فایتوپلاسماها در اواخر فصل رشد به حداکثر میزان خود می رسد). در مورد PPV بهترین زمان نمونه برداری، در بهار یا اوایل تابستان (زمانی که درجه حرارت 28 °C ـ 18 می باشد) است؛ ولی به طورکلی بسته به شرایط آب و هوایی منطقه عملیات ردیابی را می توان در هر موقع از سال انجام داد.
نمونه برداری صحیح بافت از درخت
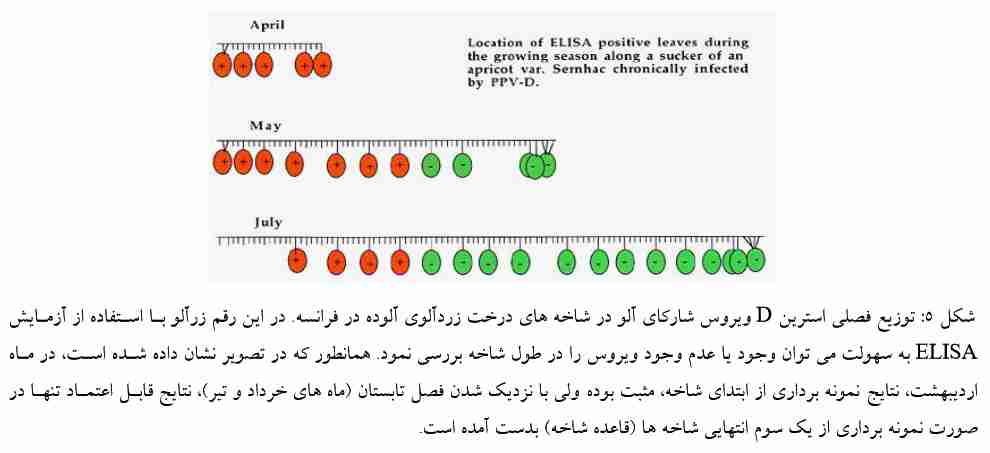
برای تعیین وجود PPV در درخت، نمونه برداری بافت برگی باید از یک سـوم قـسمت میـانی شـاخه یـا قاعده شاخه (شکل (5 و از نقاط مختلف دور تا دور درخت انجام پذیرد. زیرا در فصل بهـار، علائـم آلـودگی روی برگ های اولیه شاخه های جوان ظاهر می شود. با گذشـت زمـان و افـزایش درجـه حـرارت، غلظـت ویـروس در برگ های جوان بعدی کاهش یافته، ولی برگ های اولیه ای که در اوایل فصل دارای علائم بوده و اکنـون در میانـه شاخه قرار دارند، محتوی غلظت بالایی از ویروس می باشند؛ بنابراین اسـتفاده از بـرگ هـای ایـن بخـش از شـاخه احتمال نتیجه منفی از بافت گیاهی آلوده را به حداقل می رساند و از آنجایی که تمـامی شـاخه هـای روی درخـت آلوده علائم برگی ندارند (به دلیل توزیع نا متوازن ویروس)، نمونه برداری از هر چهار طرف درخت، الزامی است.
روش نمونه برداری در باغ
برای بررسی درختان یک بلوک یا باغ، می تـوان از سیـستم نمونـه بـرداری Hughes و Gottwald اسـتفاده نمود. در ذیل خلاصه ای از روش نمونه برداری آورده شده است که درآن درختان هر بلوک به گروه های چهـار تـایی تقسیم شده اند. برای مثال یک بلوک با 400 درخت، متشکل از 100 گروه چهار تایی بوده که هر گروه با آرایش 2×2 قرار داده شده است. اولین گروه (شامل چهار درخت) را به طور تصادفی انتخـاب و نمونـه بـرداری مـی نمـائیم و سپس نمونه برداری از گروه های بعدی با فاصله های منظم انجام میشود. حضور PPV در سطح هرگروه، باید بـه طور اختصاصی ثبت گردد (هر گروه ممکن است به ویروس آلوده باشد و یا اینکه آلوده نباشد). پیشنهاد شده اسـت که همیشه برای تهیه بهترَطرح اولیه بلوک، ابتدا نقشه محل مورد بررسی را رسم کرده و گروههای نمونـه بـرداری در آن مشخص گردد.
جمع آوری نمونه برگی
تا جائی که امکان دارد نمونه برداری می بایست از برگ های دارای علائمَ آلودگی به PPV صـورت پـذیرد. بنابراین باید به خاطر داشت که بسیاری از درختان آلوده ممکن است فاقد علائم باشند؛ زیرا علاوه بر تاثیر نوع رقـم کاشته شده در ظهور علائم، نشانه های بیماری غالبا تا سه سال بعد از وقوع آلودگی در درخت دیده نمی شوند.
برگهای هر چهار درخت، یک نمونه مزرعه ای ( field sample ) را تشکیل میدهد. از هر یک از شاخه های انتخاب شده درخت، یک برگ جمع آوری میشود. بنابراین یک نمونه مزرعه ای در کـل متـشکل از 12 یـا 16 عـدد برگ است که از 3 یا 4 شاخه انتخاب شده، جمع آوری می شود. نمونه های برگی را می توان در یک کیسه نگهـداری کرد. قبل از انجام آزمایش ابتـدا مـی بایـست از هـر field sample یـک نمونـه مرکـب آزمایـشگاهی ( composite ( laboratory sample تهیه شود که شامل نصف تعداد برگ های موجود در نمونه مزرعه ای (field sample) است.
نمونه های مرکب آزمایشگاهی باید از هشت برگ کمتر باشند. بنابراین در صورتیکه نمونه بـرداری از 12 برگ (سه برگ از هر درخت) و یا 16 برگ (چهار برگ از هر درخت) باشد، نصف این تعداد (یعنی 6 یا 8 برگ) برگهای موجود در نمونه مرکب آزمایشگاهی را تشکیل می دهند. برگ ها می بایست به حـد کـافی رشـد کـرده و از یک سوم طول میانی شاخه سال جاری باشند
اندام های گیاهی باید در کیسه های پلاستیکی زیپدار و پس از خـروج کامـل هـوای داخـل پلاسـتیک، جمع آوری گردند. کیسه ها میبایست با استفاده از خودکار ضد آب یا برچسبهای بارکد دار، مشخص گردند. نمونه های برگی باید بدون هیچ کاغذ یا هر ماده دیگری که بتواند رطوبـت نمونـه هـا را کـاهش دهـد، در کیسه های پلاستیکی قرار داده شوند. در صورتی که سطح برگها خیلی مرطوب باشند، می بایست قبل از بسته بنـدی، رطوبت اضافی برگ ها را بوسیله تکان دادن و یا با استفاده از دستمال کاغذی کاهش داد. زیرا رطوبـت سـبب رشـد باکتریها و قارچها و از بین رفتن نمونه ها و در نتیجه کوتاه شدن زمان نگهداری آنها میگردد.
به منظور کاهشَ اختلال در میزان جذب خوانـدنی در آزمـایش الایـزا، بهتـر اسـت نمونـه هـا سـریعا بـه آزمایشگاه قرنطینه انتقال داده شوند و در صورت عدم ارسال سریع به آزمایشگاه، نمونه ها می بایـست در یخچـال نگهداری شوند. آزمایشگاه دریافت کننده باید مجهز به تمامی امکانات و وسایل مرتبط با نگهداری نمونه هـا باشـد. همچنین متخصص آزمایشگاه می بایست از دریافت نمونه مطلع بوده و این نکتـه را مـد نظـر داشـته باشـد که ایـن بیماری _یک بیماری قرنطینه ای_ است.
انتقال نمونه های مشکوک به آزمایشگاه
رعایت موارد ذیل الزامی است:
- نام و آدرس گیرنده
- نام و آدرس فرستنده
- درج عبارت: _فوری / نمونه گیاهی مشکوک به آلودگی در جای خنک نگهداری شود.
بسته محتوی نمونه باید در ظروف نگهدارنده سرما (مانند کلمن های کوچـک) یـا جعبـه هـای یونـولیتی حاوی یخ خشک بسته بندی شود.
جمع آوری نمونه، حمل و نگهداری
تمامی نتایج میبایست در فرم های مناسب ثبت گردد. در زیر نمونه هایی از فرمهـای ارسـال نمونـه، فـرم ورود به آزمایشگاه، فرم نمونه برداری الایز و worksheet الایزا ، نقشه الایزا، اسـتخراج اسـید نوکلئیـک و RT-PCR آورده شده است. علاوه بر این، کاغذ پرینت نتیجه پلیت الایزا بـه همـراه دیگـر فـرم هـای الایـزا، پیوسـت شـده و نگهداری می گردد. فرم ها باید دارای شماره صفحه به همراه شماره آزمایش بوده و تمامی اطلاعات بطور پشت سر هم در یک محل جمع آوری گردد. نتایج نهایی یا گزارش موقت به دست آمده به فرستنده نمونه ها ارسـال خواهـد شد. یک کپی از این گزارش باید به همراه تمام فایلهای پیوست شده، در محل آزمایشگاه نگهـداری گـردد. در ذیـل نمونه ای از انواع فرم هایی که می تواند در جمع آوری اطلاعات مورد استفاده قرار گیرد آورده شده است. علاوه بر این، فرم های مذکور در تصویب سیستم مدیریت کیفیت آزمایشگاه های محلی می تواند تاثیر گذار باشد.
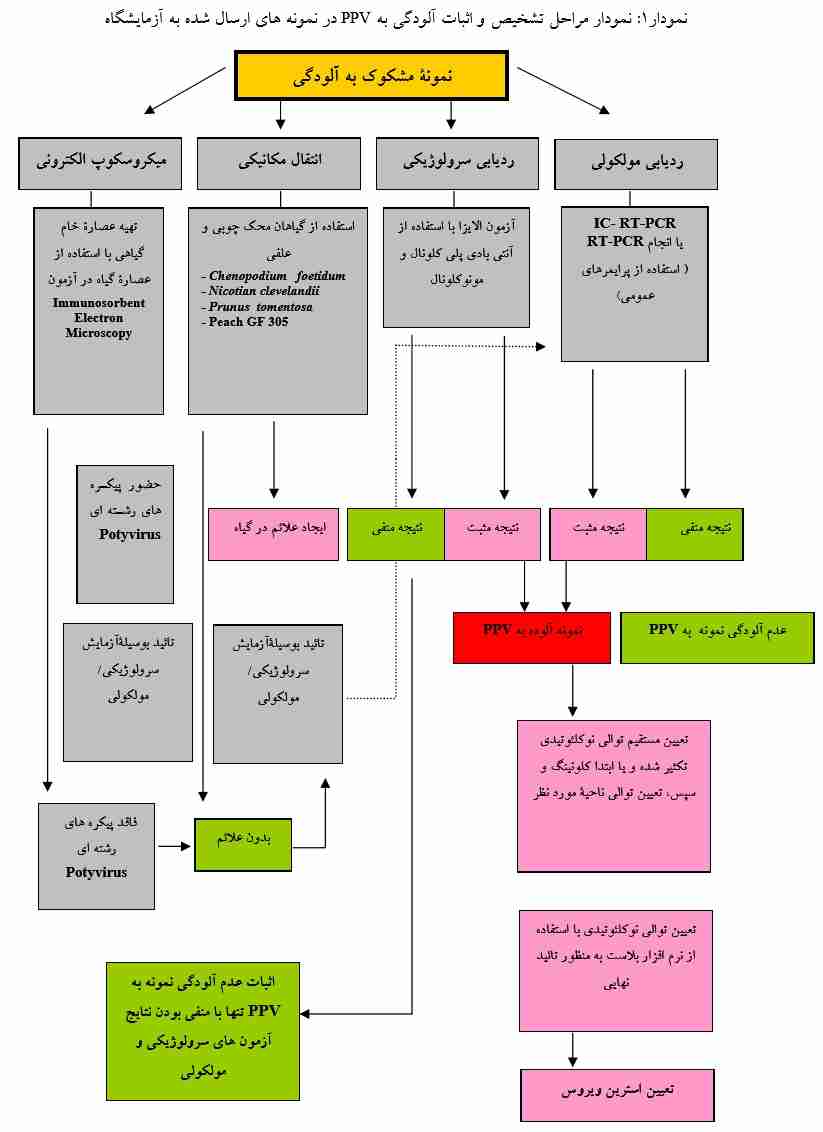
دستورالعمل تشخیص
بر اساس توصیه چندین سازمان کشاورزی مهـم ماننـد Deptment of agriculture, Fisheries and foresty استرالیا و Plant Health Australia ،استفاده از مراحل اجرایی ذیل به منظور ردیابی، تشخیص و اثبات آلودگی نمونـه های جمع آوری شده به Plum Pox Virus ضروری است. ولی با توجه به عدم امکانـات کـافی در بـسیاری از آزمایـشگاه هـای کشور برای انجام تمامی روشهای ذکر شده، نیاز به تشخیص سریع این بیماری در محصولات وارداتـی و همچنـین ردیابی به موقع آن در باغات درختان میوه هسته دار (به منظور سرعت در انجام عملیـات ریـشه کنـی و ممانعـت از گسترش ویروس)، لازم است کارشناسان قرنطینه گیاهی، استفاده از روش های سرولوژیکی و مولکولی را در دستور کار خود قرار دهند.
آزمون سرولوژیک
با استفاده از آزمون الایزا می توان از نظر سرولوژیکی پروتئین پوششی Plum Pox Virus را با استفاده از آنتی بادی های پلی کلونال و مونوکلونال به آسانی ردیابی و تعیین کمیت نمود. امروزه الایزا بعنوان یکی از قدرتمندترین روشهای آزمایشگاهی – تحقیقاتی در جهان مطرح میباشد. این روش از حساسیت بسیار بالایی برخوردار است بطوری که قادر است غلظت یک تا ده نانوگرم در هر میلی لیتر را ردیابی کند.
آزمون الایزا براساس واکنش آنتی بادی با آنتی ژن عمل می کند. در آزمونهای الایزا یک آنتی بادی اختصاصی با یک آنتی ژن معین، واکنش داده و سپس با استفاده از یک آنتی بادی اتصال یافته با یک آنزیم بعنوان سیستم نشانگر، آزمون ادامه یافته و درنهایت با افزودن سوبسترای آنزیم و تبدیل سوبسترا به محصول که یک ماده رنگی میباشد، آزمون الایزا به پایان میرسد. طول موج رنگ بدست آمده که نشانگر حضور یک آنتی بادی (و یا آنتی ژن) و نیز غلظت آن میباشد توسط یک دستگاه اسپکتروفتومتر خوانده شده و ثبت می گردد.
برای شناسایی نژادهای اختصاصی ویروس می توان از آنتی بـادی مونوکلونـال اختـصاصی نـژاد هـا و از روش های ( DASI-ELISA (Double Antibody Sandwich Indirect ELISA و یا (Triple Antibody Sandwich (TAS استفاده کرد.
نسخه برداری معکوس – واکنش زنجیره ای پلیمراز (RT-PCR)
واکنشهای زنجیره ای پلی مراز (PCR) و نـسخه بـرداری معکـوس واکـنش زنجیـره ای پلـی مـراز (Reverse transcription PCR) به دلیل حساسیت زیاد بطور گسترده ای در تشخیص و بررسیهای ویروسی بکار میروند. در تـشخیص ژنهای موجودات دارای ژنوم RNA مانند اغلب ویروس های گیاهی، ابتدا با استفاده از آنزیم Reversetrnscriptase از ژنوم RNA ویروس، رشته مکمل یا (complementary) cDNA سـاخته شـده و پـس از آن این رشته مکمل به عنوان الگو یا هدف برای تشخیص عامل بیماریزا مورد استفاده قرار می گیرد. بـه ایـن دلیـل به این نوع واکنش، نسخه برداری معکوس (Reverse transcription) گفته میشود. ناحیه ژنـی مـورد اسـتفاده بـرای تشخیص ویروس آبله آلو و تعیین استرینهای آن ، توالی کد کننده پروتئین پوششی در ناحیهِ3 ژنوم میباشـد. البتـه از نواحی دیگر ژنوم نیز می توان برای بررسیهای تکمیلی مانند بررسی استرین های قابل انتقال توسـط حـشره و یـا استرین های غیر قابل انتقال با حشره نیز استفاده نمود. در ذیل، به توالی نوکلئوتیدی پرایمـرهـای اختـصاصی مـورد استفاده در تشخیص مولکولی ویروس آبله آلو اشاره میشود:
راهکارهای مدیریت بیماری
اغلب مشکلات جدی ناشی از بیماریهای ویروسی در گیاهان ، نتیجه فعالیتهای مستقیم و غیر مستقیم بشر است. لذا استفاده از تمهیداتی که موجب ممانعت از اپیدمی بیماری در یک منطقه مـیشـود از اهمیـت زیـادی برخـوردار است. بنابراین در کنترل بیماریهای گیاهی، دستیابی و کاربرد چندین روش کنترل بـرای مـدیریت بیمـاری توصـیه میشود.
- اعمال ضوابط قرنطینه، بهترین روش برای کنترل ویروس آبله آلو است. با اعمال ضوابط قرنطینـه ای و وضع قوانین و بازرسیهای دقیق اندامهای گیاهی وارداتی میتوان به راحتی از ورود ویـروس بـه منـاطق کشت میوه جلوگیری کرد. برای دستیابی به این هدف، انجـام بررسـیهـای آزمایـشگاهی روی انـدامهای وارداتی به منظورتائید عاری بودن آنها از آفات و بیماریها، مخصوصا عواملی که در کشور وجود ندارنـد ضروری است. همچنین افرادی که در تولید و تکثیر تجاری این نوع اندامهای گیـاهی اشـتغال دارنـد نیـز میبایست از نهالستانهای عاری از ویروس و گواهی شده، نهالهای مورد نظر خود را خریداری نمایند.
- راهکار بعدی برای مدیریت بیماری ویروسی آبله آلو ، کنترل گسترش آن با حذف و از بین بردن گیاهان آلوده بلافاصله پس از تشخیص بیماری در آنها میباشد. به دلیل توزیع نامنظم بیماری و اینکـه غلظـت ویـروس در برخـی از اندامهای گیاهی به حدی نیست که در تستهای آزمایشگاهی قابـل ردیـابی باشـد، ممکـن اسـت نمونـه برداری از گیاهان مشکل باشد. در این موارد توصیه میشود در طـول فـصل رشـد بطـور مـنظم از منـاطق مشکوک به آلودگی هسته داران داخل باغ و همچنین گیاهان اطراف آن، نمونه برداری صورت گرفته تا در صورت تائید آلودگی بلافاصله اقدام به حذف درختان منطقه گردد. در انگلستان، باغات با آلودگی بیش از ده درصد بطور کامل حذف میشوند. زیرا هم از نظر تهدیدی که برای باغات اطراف آن وجود دارد و هم از لحاظ اقتصادی، مدیریت آن مشکلتر است. بقایای درختان پس از ریشه کنی با بولدوزر و یا ابزارهـای دیگر قطع درخت میبایست کاملا از بین برود، در غیر این صـورت ایـن بقایـا خـود منبـع خـوبی بـرای گسترش PPV خواهند بود. پاجوشها نیز باید با استفاده از علفکـشهـا از بـین بـرده شـوند. در اروپـا توصیه شده است که تا سه سال پس از ریشه کنی بیماری ویروسی آبله آلو ، از کاشت دوبـاره درختـان میـوه هـسته دار در منطقـه جلوگیری شود.
- کاربرد حشره کشها به دلیل کاهش جمعیت شته تا حدی به کاهش گسترش بیماری ویروسی آبله آلو کمک مـیکنـد ولـی در عمل نشان داده شده است که استفاده از این روش، در کنترل بیماری ویروسی آبله آلو کـارایی کمـی دارد زیـرا وجـود حتی یک حشره ناقل نیز قادر است ظرف چند ثانیه ویروس را منتقل کند. علاوه بر آن ردیابی دقیق گونـه شته نیز به دلیل اینکه غالبا بصورت فـرمهـای مهـاجرتی متفـاوت وجـود دارنـد مـشکل اسـت. در اکثـر کشورهای اروپایی، از حشره کشها به دلیل ایجاد مقاومـت در آفـت ، بـروز آفـات ثانویـه و اخـتلال در پایداری برنامه های مدیریتی در باغات درختان میوه هسته دار استفاده نمیشود.
- از آنجایی که برخی از علفهای هرز غالب در باغ؛ میزبان طبیعی ویروس آبله آلو هـستند، مـدیریت علف هرز در باغ و اطراف آن ممکن اسـت گـسترش ویـروس آبله آلو را کـاهش دهـد. لـیکن، تـاکنون و بطـور مشخص ارتباط بین ویروس و علف هرز مشاهده نشده است.
- اصلاح نباتات و مهندسی ژنتیک : در برنامه های کنترل بیماری ویروسی آبله آلو از طریق استفاده از اصـول بـه نـژادی شناسـایی اسـترین غالـب در منطقـه و پراکنش آن از اهمیت زیادی برخوردار است. در حال حاضر هـیچ واریتـه مقـاوم تجـاری وجـود نـدارد. ژنهای مقاومت در برخی از واریته های آلو شناسایی شده ولی انتقال این ژنها به دیگر هـسته دارن کـاری مشکل و زمانبر است. گروهی از دانشمندان آمریکایی و فرانسوی، از طریق دورگ گیری توانسته اند آلوی مقاوم به PPV با نـام رقم Honey Sweet تولید کنند که در سال 2007 این رقم با تایید سرویس بازرسی سـلامت گیاهـان و حیوانات آمریکا (The Animal and Plant Health Inspection Service) رسید و هم اکنون بـه عنوان یک منبع منحصر بفرد در برنامه های اصلاح نژادی میباشد.
تهیه کنندگان : الهام محمدی ، فرهاد گوهرزاد ، حسن مسعودی